Hemos observado durante las últimas décadas cómo los descubrimientos de la ciencia, aplicados a la medicina, han sido cruciales para lograr el aumento de la esperanza de vida. Sin embargo, el reto de los científicos es lograr más vida con mejor salud. En otras palabras, cada vez más individuos deberían alcanzar la edad de 122 años (hoy en día) y gozar de buena salud en edades avanzadas. Imaginemos poder sentir la fuerza y la robustez de los cuarenta a los 80 o 90 años. Si este fuera el caso, ¿Por qué el pico de fertilidad femenina está alrededor de los 20 y los 30 años? Esta pregunta no surge únicamente por la necesidad de decidir la mejor edad para tener hijos, sino porque el riesgo de sufrir enfermedades asociadas al envejecimiento aumenta cando los ovarios envejecen.
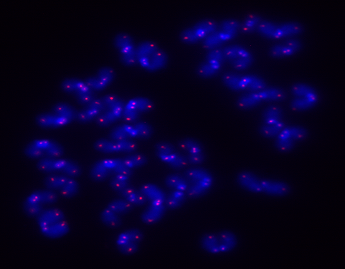
Varias rutas biológicas están implicadas en longevidad1, pero una de las más importante es la ruta encargada de proteger los telómeros (ruta de los telómeros) ya que su fallo impacta y distorsiona otras rutas que también están implicadas en el envejecimiento1. Los telómeros son estructuras especializadas que se encuentran en los extremos de los cromosomas y sirven para protegerlos de degradación y fusiones2, por tanto, previenen la inestabilidad genómica, que es la antesala del cáncer y el envejecimiento. Los telómeros en mamíferos consisten en repeticiones en tándem de la secuencia de ADN “TTAGGG”, que llega a alcanzar entre 10 y 15 kb en humanos y 40 kb en ratones. La secuencia telomérica se enrolla alrededor de los nucleosomas (unas proteínas especializadas en mantener la estructura de los cromosomas) que están marcados para mantener la transcripción de los telómeros controlada. A los telómeros se les une un complejo de seis proteínas llamado Shelterina que contribuye a su protección. Otro estrato de protección está asegurado mediante unos RNAs largos que no codifican proteínas llamados Terras, que son atraídos y se unen a los telómeros3,4,5.
La maquinaria de replicación de las células no puede copiar íntegramente los telómeros, por eso, cuando las células se dividen la longitud telomérica se acorta. Si los telómeros alcanzan una longitud críticamente corta no pueden ser protegidos adecuadamente3,4,5, por tanto, la célula detecta daño en los cromosomas y activa los sistemas de reparación de daño, que llevan a la senescencia o a la apoptosis celular. Estas células ya no se pueden dividir más. Si el número de células senescentes aumenta en el organismo, la capacidad regenerativa de los tejidos y los órganos se reduce y el organismo envejece6. La telomerasa es una enzima que puede añadir repeticiones en los extremos de los cromosomas, y así, contrarrestar el acortamiento telomérico que sucede durante la replicación cromosómica, evitando que los telómeros alcancen una longitud críticamente corta7. Sin embargo, la actividad telomerasa no es detectable en la mayoría de las células del organismo; únicamente se detecta en células madre embrionarias y adultas, así como en células cancerosas. No obstante, la falta de actividad telomerasa protege a las células del cáncer, ya que en la mayoría de los tumores se ha observado actividad telomerasa8.
El envejecimiento del organismo debido al acortamiento telomérico se ha demostrado en ratones que no tienen la enzima telomerasa. En estos ratones se acumulan los telómeros cortos y envejecen muy rápido, pero muestran resistencia al cáncer9. El mismo fenómeno se observa en humanos con mutaciones en la telomerasa, los cuales sufren enfermedades muy severas, como la disqueratosis congénita10, con una capacidad muy limitada para la regeneración de los tejidos10.
Hay evidencia de la implicación de la ruta de los telómeros en la fertilidad. En los ratones sin telomerasa (que acumulan telómeros cortos) la fertilidad se pierde en la sexta generación, mientras que los ratones control se pueden reproducir durante muchas generaciones. Los órganos reproductores femeninos y masculinos, así como la producción de gametos están alterados11,12. Con respecto a los órganos reproductores femeninos se observa una baja producción de ovocitos junto con un impedimento del desarrollo embrionario y el deterioro en la estructura y función del útero. Además, los ovocitos de ratones de la cuarta generación presentan los cromosomas desalineados en la placa metafásica y aberraciones en el huso acromático, lo cual sugiere que los telómeros representan un papel importante en la estructura de los ovocitos. En cuanto al aparato reproductor masculino, hay un deterioro en la estructura de los testículos y una marcada disminución en la producción de espermatozoides11,12.
También hay evidencia de la implicación de la ruta de los telómeros en la fertilidad humana. En casos de insuficiencia y fallo ováricos, se ha detectado acumulación de telómeros cortos y falta de actividad telomerasa en leucocitos y en células de la granulosa (GC; células que nutren y ayudan a la maduración de los ovocitos)13, 14. En cuanto a los hombres, la acumulación de esperma con telómeros más cortos y disfuncionales se ha observado en casos de baja fertilidad. En casos de semen oligospérmico (semen con menor cantidad de espermatozoides de lo normal) se acumulan más telómeros cortos, comparados con los controles (fertilidad normal)15,16.
A pesar de los esfuerzos para comprender la implicación de la biología de los telómeros en la fertilidad, hace falta más investigación para entender los mecanismos que coordinan la infertilidad y el envejecimiento, con el fin de poder alargar la vida reproductiva de manera segura. Así se podría garantizar la salud a edades avanzadas, y las parejas dispondrían de un periodo de tiempo más amplio para tener hijos, pudiendo elegir el momento más adecuado para ello.
Post escrito por Elisa Varela, Ph.D.
Bibliography
- López-Otín, C., Bkasco, M.A., Partridge, L., Derrano, M. and Kroemer, G. The hallmarks of aging. 2013. Cell 153: 1194 – 1217.
- Blackburn, E., Epel, E.S. and Lin, J. Human telomere biology: a contributory and interactive factor in aging, disease risks, and protection. 2015. Science 350: 1193 – 1198.
- de Lange, T. Shelterin the protein complex that shapes and safeguards human telomeres. 2005. Genes Dev. 19: 2100 – 2110.
- de Lange, T. Shelterin-mediated telomere protection. 2018. Annu. Rev. Genet 52: 223 – 247.
- Martínez, P. and Blasco, M.A. Role of shelterins in cancer and aging. 2010. Aging Cell 9: 653 – 663.
- Donate, L.E. and Blasco M.A. Telomeres in cancer and ageing. 2011. Philos. Trans. R. Soc. Lon. B. Biol. Sci. 366: 76 – 84.
- Greider, C.W. and Blackburn, E.H. Identification of a specific telomere terminal transferase activity in Tetrahymena extracts. 1985. Cell 43: 405 – 413.
- Maciejowski, J. and de Lange, T. Telomeres in cacner: tumour suppression and genome instability. 2017. Nature Reviews 18: 175 – 186.
- Blasco, M.A., Lee, H., Hande, M.P. Samper, E. Lansdorp, P.M. DePinho, R.A. and Greider, C. W. 1997. Telomere shortening and tumor formation by mouse cells lacking telomerase RNA. Cell 91: 25 – 34.
- Merck, S. J. and Armanios, M. Shall we call them “telomere-mediated”? Renaming the idiopathic after the cause is found. 2016. Eur. Respir 48: 1556 – 1558.
- Lee, H., Blasco, M.A., Gottlieb. G.J., Horner, J.W., Greider, C.W. and DePinho, R.A. Nature 1998. Nature 392: 569 – 574.
- Liu, L. Blasco, M.A. and Keefe, D. Requirement of functional telomeres for metaphase chromosome alignments and integrity of meiotic spindles. 2002 EMBO Reports 31: 230 – 234.
- Xu, X., Chen, X., Zhang, X., Liu, Y., Wang, Z., Wang, P., Du, Y., Qin, Y. and Chen, Z. 2017. Impaired telomere length and telomerase activity in peripheral blood leukocytes and granulosa cells in patients with biochemical primary ovarian insufficiency. Human Reproduction 32: 201 – 207.
- Butts, S., Riethman, H., Ratcliffe, S., Shaunik, A., Coutifairs, C. and Barnhart, K. Correlation of telomere length and telomerase activity with occult ovarian insufficiency. 2009. J. Clin. Endocrinol. Metab. 94: 4835 – 4843.
- Cariati, F., Jaroudi, S., Alfarawati, S. Raberi, A. Alviggi, C., Pivonello, R. and Wells, D. Investigation of sperm telomere length as a potential marker of paternal genome integrity and semen quality. 2016. Reproductive Biomedicine online 33: 404 – 411.
- Biron-Shental, T., Wiser, A., Hershko-Klement, A., Markovitch, O., Amiel, A. and Berkovitch, A. Sub-fertile sperm cells exemplify telomere dysfunction. 2018. J. Assist Reprod. Genet. 35: 143 – 148.